Introducción
Entre los diferentes y numerosos cambios culturales experimentados durante la dispersión y el asentamiento de los humanos modernos, algunos de los más importantes están asociados con el consumo de alimentos (Lieberman, 1997). Lieberman (2002) sostiene que las funciones mecánicas que involucran interacciones músculo-hueso, como la manipulación de objetos, la locomoción o la masticación, pueden afectar los procesos que ocurren durante el crecimiento y desarrollo, en especial en fases tardías, y promover cambios de tamaño y/o forma en las estructuras óseas que operan como soporte e inserción a los músculos involucrados. En este mismo sentido, varios autores concluyen que la evolución del rostro humano probablemente ha sido influenciada por una respuesta a las cargas masticatorias originadas en variaciones de dureza, tenacidad y tamaño de partícula de la dieta (e.g., Corruccini y Handler, 1980; Beecher y Corruccini, 1981; Corruccini y Beecher, 1982, 1984; Beecher, Corruccini y Freeman, 1983; Corruccini, Henderson y Kaul, 1985; Ingervall y Bitsanis, 1987; Larsen, 1995, 1997; Ciochon, Nisbett y Corruccini, 1997; Corruccini, 1999; Lieberman, Krovitz, Yates, Devlin y Claire, 2004; González-José et al., 2005; Lieberman, 2008; Paschetta et al., 2010; Noback y Harvati, 2015).
El desarrollo y la incorporación de tecnologías (técnicas de cocción, herramientas, cerámica, etc.) posibilitaron el procesamiento de los alimentos con el consecuente cambio en sus características; se asume que este avance tecnológico permitió el consumo de alimentos más blandos y procesados (Lieberman et al., 2004). Es probable que la disminución de las cargas masticatorias, originadas con el surgimiento de dietas más blandas, haya desencadenado cambios en la relación entre la fuerza de trabajo muscular y el crecimiento óseo. El estrés mecánico impuesto por los músculos induce al crecimiento óseo especialmente a una edad temprana de vida (Pearson y Lieberman, 2004; Hallgrimson y Lieberman, 2008). Por ejemplo, masticar alimentos sólidos genera una gran tensión en la parte inferior de la cara, por lo tanto, una dieta poco procesada y más rígida debería promover un mayor crecimiento en la mandíbula, la porción inferior del maxilar y otras regiones del cráneo sometidas a grandes esfuerzos masticatorios (Wood y Lieberman, 2001; Eyquem, Kuzminsky, Aguilera, Astudillo y Toro-Ibacache, 2019). En este sentido, varios autores sostienen que la transición de un estilo de vida cazador-recolector a uno agrícola probablemente resulta en una reducción de la actividad masticatoria y una tendencia hacia la gracilización general del cráneo (Carlson, 1976; Carlson y Van Gerven, 1977; Brace, Rosenberg y Hunt, 1987; Hannam y Wood, 1989; Brace, Smith y Hunt, 1991; van Spronsen, Weijs, Valk, Prahl-Andersen y van Ginkel, 1991; Kiliaridis, 1995; Larsen, 1995, 1997; Lieberman et al., 2004; Sardi, Novellino y Pucciarelli, 2006; Pinhasi, Eshed y Shaw, 2008; Noback y Harvati, 2015).
El crecimiento facial se ve afectado por las cargas mecánicas provocadas por la masticación, como queda en evidencia en diversos estudios que han utilizado modelos animales para poner a prueba la relación entre las tensiones mecánicas masticatorias y el crecimiento óseo. Los resultados indican que la masticación genera un gradiente de tensiones en la cara que van disminuyendo desde el plano oclusal hacia la parte superior del rostro (Hylander y Johnson, 1992; Hylander, Picq y Johnson, 1991; Ross y Hylander, 1996; Ross, 2001; Lieberman et al., 2004). Además, las regiones de origen e inserción muscular (arco cigomático, proceso coronoides) experimentan tensiones de gran magnitud (Hylander et al., 1991; Hylander y Johnson, 1992; Lieberman et al., 2004). En humanos, los trabajos experimentales se centraron en medir la actividad muscular de los músculos masetero y temporal mediante el uso de sensores adheridos en la piel, a travez de los cuales se registró la actividad eléctrica de los músculos bajo condiciones de dieta rígida versus dieta blanda. En general, los resultados coinciden en que existe un incremento significativo de la actividad muscular bajo condiciones de dieta rígida (Peyron, Lassausay y Woda, 2002; Foster, Woda y Peyron, 2006; Iguchi et al., 2015; van der Bilt y Abbink, 2017; Tonni et al., 2020). Además de estos trabajos experimentales, existen otros que miden el efecto de las diferentes dietas en poblaciones naturales que han experimentado cambios en sus estrategias económicas. Estas investigaciones indican que el consumo de alimentos rígidos y/o no procesados se evidencia en una variedad de rasgos como el incremento en la robustez general (Larsen, 1995, 1997) o el tamaño del cráneo (Sardi et al., 2006); incremento facial (Carlson y Van Gerven, 1977); aumento en el área del músculo temporal (Carlson, 1976; Carlson y Van Gerven, 1977; González-José et al., 2005; Sardi et al., 2006); incremento del tamaño de la articulación témporo-mandibular (Hinton y Carlson, 1979; Corruccini y Handler, 1980; Paschetta et al., 2010); mayor espesor de los huesos de la bóveda craneana (Hylander, 1986; Lieberman, 1996); mayor tamaño de la mandíbula (von Cramon-Taubadel, 2011; Rando, Hillson y Antoine, 2014), y cambios en los patrones de integración y variación morfológica en estructuras directamente involucradas en la mecánica masticatoria (Paschetta et al., 2016).
Los antecedentes parecerían indicar que existen relaciones causales entre el tamaño y/o la forma del cráneo y la actividad masticatoria. Sin embargo, esta relación está lejos de ser sencilla, y numerosos efectos ambientales y poblacionales deben ser tenidos en cuenta como potenciales fuentes de variación craneofacial. Generalmente, el énfasis ha estado depositado en detectar cambios en tamaño y forma del cráneo o de estructuras intracraneales (e.g., Hinton y Carlson, 1979; Corruccini y Handler, 1980; Larsen, 1995; 1997; Sardi et al., 2006, entre otros), pero la verdadera ventaja mecánica reside en parámetros biomecánicos que, en principio, son independientes del tamaño y la forma, tales como la fuerza de mordida, los brazos de carga y palanca de los diferentes músculos implicados, etc. (Lieberman, 1997). Este refinamiento en la observación de las diferencias entre grupos sometidos a diferentes cargas masticatorias es necesario para comprender en su real dimensión el tipo y magnitud de cambio morfológico experimentado durante la transición tecnológica.
El objetivo de este trabajo es estimar diferencias en la morfología craneofacial en muestras correspondientes a grupos humanos con diferentes estrategias económicas y/o tecnológicas (cazadores-recolectores, agricultores, industrializados, etc.), tanto en la forma craneofacial global como en estructuras localizadas y funcionalmente relacionadas con la masticación. Además, evaluar las variaciones de tamaño y forma en diferentes niveles jerárquicos de agrupamiento (entre transiciones y entre estrategias económicas dentro de transiciones) en la forma global del cráneo, como así también en las diferentes regiones de este. Finalmente, se plantea estimar las fuerzas de mordida a nivel del segundo molar y de los incisivos centrales a partir del cálculo de las áreas transversales de los músculos temporal y masetero, y los correspondientes brazos de palanca y de carga, comparando los valores resultantes entre grupos de dieta blanda (DB) y dieta dura (DD).
Materiales y métodos
Utilizamos una muestra de 459 cráneos de humanos modernos de ambos sexos procedentes de diferentes colecciones esqueléticas (Tabla 1). El sexo y la edad se estimaron siguiendo la metodología descrita por Buikstra y Ubelaker (1994). Para el análisis de forma y tamaño del centroide del cráneo se utilizaron técnicas de morfometría geométrica; en cada cráneo se registraron 90 coordenadas de landmarks tridimensionales homólogas (Tablas suplementarias 1 y 2, Figura suplementaria 1) utilizando un digitalizador Microscribe G2X. Del total de coordenadas, 64 corresponden a landmarks de tipo I y II, mientras que 26 se colocaron adaptando el método de Maddux y Franciscus (2009) para capturar con más detalle la forma del músculo temporal. Para esto se proyectó una cuadrícula de 6 × 6 celdas en el lateral del cráneo utilizando cuatro landmarks anatómicos: stephanion (punto superior), radicular anterior (punto inferior), entomion (punto posterior) y frontotemporal (punto anterior) como límites de la cuadrícula, y las intersecciones de las líneas verticales y horizontales se utilizaron para definir 24 puntos de referencia adicionales (Maddux y Franciscus, 2009). Ambas configuraciones se combinaron utilizando la rutina DVLR.msi (Reddy, 2012).
Tabla 1
Detalles de las muestras
|
Transición económica |
Colección |
n |
Subsistencia |
Cronología |
Subtotal |
|
F |
M |
T |
|
Cuyo |
Puelches |
14 |
14 |
28 |
Cazadores-recolectores (dieta dura) |
2040-1755 AP |
|
|
|
Huarpes |
7 |
5 |
12 |
Agricultores (dieta blanda) |
500-800 AP |
40 |
|
Valle Central de México |
Tlatelolco/San Gregorio Atlapulco |
25 |
23 |
48 |
Agricultores (dieta dura) |
1200-1521 AP |
|
|
|
San Andrés/ San José de los Naturales |
71 |
63 |
134 |
Colonial (dieta blanda) |
Siglos XVII, XVIII y XIX |
|
|
|
Actuales |
14 |
29 |
43 |
Moderna (dieta blanda) |
Contemporánea |
225 |
|
Valle del río Ohio |
Indian Knoll Archaic |
40 |
40 |
80 |
Cazadores-recolectores (dieta dura) |
3200-2700 AP |
|
|
|
Late Prehistory |
1 |
11 |
12 |
Agricultores (dieta blanda) |
1000-350 AP |
92 |
|
Chubut |
Chubut |
9 |
26 |
35 |
Cazadores-recolectores (dieta dura) |
2400-270 AP |
35 |
|
Delta del río Paraná |
Delta |
7 |
10 |
17 |
Cazadores-recolectores (dieta dura) |
700-800 AP |
17 |
|
Doncellas |
Doncellas |
20 |
30 |
50 |
Agricultores (dieta blanda) |
509-585 AP |
50 |
|
Total |
|
208 |
251 |
459 |
|
|
459 |
Posteriormente, la configuración total de los puntos de referencia se dividió en 11 subconjuntos de puntos anidados jerárquicamente. Todo el cráneo representa el primer orden jerárquico; las configuraciones de segundo orden representan tres estructuras diferentes: neurocráneo, cara y aparato masticatorio; el neurocráneo se dividió en bóveda y base, que representan regiones de tercer orden; la cara se separó en cara superior e inferior (subconfiguraciones de tercer orden); y la región masticatoria se dividió en las subconfiguraciones temporal, articulación témporo-mandibular y alveolar, las tres de tercer orden.
Muestra
Analizamos una muestra (Tabla 1) compuesta por tres poblaciones en transición (Cuyo, Valle Central de México y Valle del río Ohio); es decir, grupos que habitaron un mismo espacio geográfico y que a lo largo del tiempo incorporaron diferentes tipos de alimentos y tecnologías asociadas a su elaboración. Este tipo de muestras que no han experimentado grandes cambios genéticos mediados por procesos como deriva, migración, etc., representan la posibilidad de asumir que el efecto estudiado se encuentra libre de las consecuencias que acarrean los movimientos demográficos. Por otro lado, las tres poblaciones no transicionales (Chubut, delta del río Paraná y Doncellas) representan un tipo particular de dieta en un determinado momento.
Cuyo (Argentina)
Los antiguos habitantes de la región pueden ser divididos en dos grupos de acuerdo con su estrategia económica y su ubicación geográfica: cazadores-recolectores (CR-CU) al sur del río Diamante y agricultores (A-CU) al norte del mismo río (Sardi et al., 2006). El grupo de CR-CU fue asignado al período de 2040-1755 años AP por datación por radiocarbono (Novellino y Guichón, 1999), mientras que el grupo de A-CU es asignado al período Tardío (500-800 AP) debido a la presencia de alfarería y sistemas de riego (Gambier, 1993).
Valle Central (México)
La serie del Valle Central de México consiste en una transición de agricultores precontacto (A-ME) (San Gregorio Atlapulco o Xochimilco y Tlatelolco) a un grupo colonial temprano (COL-ME) (San Andrés y San José de los Naturales), y finalmente a un grupo poscolonial contemporáneo (MOD-ME) (Colección UNAM) (Gómez-Valdés et al., 2012). Todos los individuos pertenecen a sitios de la zona cercana a la Ciudad de México.
Valle del río Ohio (Estados Unidos)
Esta serie se puede dividir en dos períodos. El período más temprano, conocido como Indian Knoll-Archaic (10000 a 3000 años AP) (Hill, 2003), ampliamente aceptado como un momento habitado por grupo de cazadores-recolectores nómadas (CR-OH) (Sciulli, 1998), y un período más reciente, el Late Prehistory (1500 a 500 años AP) (Hill, 2003), que representa una población de agricultura intensiva (A-OH).
Chubut (Argentina)
La muestra proviene del valle inferior del río Chubut (Lehmann-Nitsche, 1910) y es asignada al Holoceno tardío (90-1600 AP) (Barrientos et al., 2009). El contexto tecnológico, los análisis de arqueofauna y la evidencia de isótopos estables (C 13 y N 15) sugieren que los grupos humanos de esta región pueden definirse como cazadores-recolectores (CR-CHU). Los habitantes consumían recursos terrestres y marinos, principalmente guanacos y moluscos, aunque se subexplotaban peces, aves y otros mamíferos terrestres y acuáticos. Las plantas fueron un recurso importante, el análisis isotópico y los estudios de alfarería indican el consumo de plantas C3 (Gómez Otero, 2007).
Delta del río Paraná (Argentina)
Los grupos humanos que habitaban esta región pueden ser considerados como cazadores-recolectores (CR-DEL), estrechamente vinculados a los recursos acuáticos (Bernal, Pérez, González, Sardi y Pucciarelli, 2010). De acuerdo con la datación por radiocarbono y el contexto arqueológico, esta muestra puede ser asignada al Holoceno tardío (700 a 800 AP) (Bernal et al., 2010). Bonomo, Politis y Castro (2010) argumentan que estos grupos, estrechamente asociados a los recursos fluviales (peces, moluscos, mamíferos marinos) y terrestres (vegetales, mamíferos, aves), y el desarrollo de una tecnología específica para su uso (arpones, pesca redes, rompecocos) deben haber vivido en las llanuras aluviales de los ríos.
Doncellas (Argentina)
Este sitio ubicado en la puna de Jujuy (Argentina) fue adscrito al período Tardío o Desarrollo Regional (Albeck, 2001), por datación radiocarbónica que indica una edad de 509-585 AP. La evidencia (arquitectura, artefactos de piedra) en el sitio y alrededores muestra que la población desarrolló una subsistencia campesina y pastoral (Alfaro de Lanzone, 1988). Albeck (2001) destaca que el componente agrícola alcanzó un gran desarrollo (A-DON). Existen evidencias de construcción de grandes terrazas agrícolas, complejas redes de riego, presas para almacenamiento de agua y la construcción de pozos subterráneos y silos para preservar los alimentos (semillas y tubérculos).
Para las comparaciones posteriores asumimos que CR-CU, A-ME y CR-OH representan casos de dieta más dura relativa dentro de cada transición, debido no solo al tipo de alimentos consumidos, sino también al menor grado de desarrollo tecnológico alcanzado; mientras que A-CU, COL-ME, MOD-ME y A-OH representan la contraparte de dietas más blandas, en parte por la incorporación de mayor proporción de tejido vegetal y el continuo desarrollo de técnicas utilizadas en la elaboración de alimentos. Siguiendo el mismo criterio, las muestras no transicionales (Chubut, Doncellas y delta del río Paraná) se clasificaron en dieta dura o dieta blanda; los CR-CHU y CR-DEL fueron incluidos en un grupo de dieta dura; mientras que A-DON, como grupo de dieta blanda.
Análisis estadístico
Las configuraciones de landmarks se ajustaron mediante un análisis generalizado de Procrustes (AGP) (Rohlf y Slice, 1990; Goodall, 1991) utilizando el software Morpho-J (Klingenberg, 2011). El AGP elimina los efectos de traslación, rotación y escala (Rohlf y Slice, 1990) y permite separar la información de tamaño del centroide y forma: las coordenadas de Procrustes alineadas retienen solo la información de la forma (shape), mientras que el tamaño del centroide (centroid size, cs) representa un estimador de tamaño (Dryden y Mardia, 1998). De aquí en adelante utilizaremos la palabra tamaño para hacer referencia al tamaño del centroide o centroid size (cs).
Realizamos un ANOVA anidado en las variables de tamaño (cs) y forma (coordenadas alineadas), con el objetivo de evaluar el comportamiento de los factores transición y dieta, asumiendo que los cambios en la dieta son específicos de la población y, por lo tanto, se encuentran anidados dentro de cada transición. Además, calculamos un análisis discriminante canónico para evaluar las diferencias de forma general entre las transiciones y las dietas.
Se realizó la estimación de un cálculo biomecánico, la fuerza de mordida (FM) (Figura suplementaria 2), siguiendo la fórmula propuesta por Thomason (1991): FM = (T * BPt + M * BPm) CM (M2 o I). Donde T y M son el tamaño, representado por el cs de los músculos temporal (T) y masetero (M) y representan una estimación de la fuerza transversal realizada por cada uno de los músculos; BPt y BPm son los brazos de palanca de los músculos temporal y masetero, los cuales fueron calculados como la distancia desde el centro de la articulación témporo-mandibular al centroide del área muscular; y CM es la carga muscular, o brazo de carga, calculada para la masticación bilateral (a nivel del segundo molar, M2) o la masticación unilateral incisiva (a nivel de los incisivos centrales, I), y está representada por la distancia desde el centro de la articulación témporo-mandibular al M2 o al prostion (I), respectivamente. La FM fue calculada para los grupos transicionales y aquellos que representan una sola estrategia económica y para cada sexo por separado. Estadísticamente, las diferencias de FM entre los grupos fueron estimadas mediante un test de Student y ANOVA de una vía.
Resultados
Los resultados del ANOVA anidado realizado para el tamaño se presentan en la Tabla 2 y son significativos en la mayoría de las regiones y niveles de análisis. El tamaño varía entre las transiciones para todas las regiones, a excepción de la región alveolar y temporal. Con respecto a las diferencias de tamaño debido a la dieta (anidadas en transición), todas las regiones difieren significativamente, excepto el área temporal. En términos de varianza explicada, el neurocráneo representa el 8,80% de la variación entre transiciones, seguido por la articulación témporo-mandibular (ATM) (8,04%) y la cara (7,99%). Por el contrario, las regiones que explican una mayor variación entre dietas (dentro de cada transición) son la cara inferior (7,62%), la cara (7,40%) y la alveolar (7,38%). Como era de esperar, la mayor contribución de la varianza se explica por el efecto error, que resume todas las variables no evaluadas en este trabajo.
Tabla 2
ANOVA anidado para el tamaño.
|
Efecto |
Región craneal |
% explicado |
SC |
gl |
CM |
f |
|
Transición |
Cráneo entero |
6,17 |
6896,68 |
2 |
3448,34 |
12,29** |
|
|
Cara |
7,99 |
1046,33 |
2 |
523,16 |
16,85** |
|
|
Cara superior |
5,63 |
111,57 |
2 |
55,79 |
11,23** |
|
|
Cara inferior |
3,80 |
341,94 |
2 |
170,97 |
7,67** |
|
|
Neurocráneo |
8,80 |
2901,28 |
2 |
1450,64 |
18,32** |
|
|
Bóveda |
4,00 |
1140,94 |
2 |
570,47 |
7,79** |
|
|
Basicráneo |
4,26 |
218,83 |
2 |
109,42 |
8,19** |
|
|
Masticatorio |
2,90 |
2731,87 |
2 |
1365,94 |
5,56** |
|
|
Alveolar |
0,98 |
42,67 |
2 |
21,34 |
1,91 |
|
|
ATM |
8,04 |
176,86 |
2 |
88,43 |
16,24** |
|
|
Temporal |
1,45 |
809,12 |
2 |
404,56 |
2,69 |
|
Dieta (Transición) |
Cráneo entero |
4,26 |
4764,63 |
4 |
1191,16 |
4,24** |
|
|
Cara |
7,40 |
969,83 |
4 |
242,46 |
7,81** |
|
|
Cara superior |
4,99 |
98,99 |
4 |
24,75 |
4,98** |
|
|
Cara inferior |
7,62 |
684,59 |
4 |
171,15 |
7,68** |
|
|
Neurocráneo |
5,45 |
1796,44 |
4 |
449,11 |
5,67** |
|
|
Bóveda |
4,28 |
1220,11 |
4 |
305,03 |
4,16** |
|
|
Basicráneo |
2,90 |
148,86 |
4 |
37,22 |
2,79* |
|
|
Masticatorio |
4,10 |
3864,21 |
4 |
966,05 |
3,93** |
|
|
Alveolar |
7,38 |
321,21 |
4 |
80,30 |
7,19** |
|
|
ATM |
3,59 |
79,02 |
4 |
19,76 |
3,62* |
|
|
Temporal |
2,53 |
1415,46 |
4 |
353,87 |
2,35 |
|
Error |
Cráneo entero |
89,57 |
100187,67 |
357 |
280,64 |
|
|
|
Cara |
84,61 |
11086,55 |
357 |
31,05 |
|
|
|
Cara superior |
89,38 |
1772,95 |
357 |
4,97 |
|
|
|
Cara inferior |
88,58 |
7960,21 |
357 |
22,30 |
|
|
|
Neurocráneo |
85,75 |
28266,12 |
357 |
79,18 |
|
|
|
Bóveda |
91,72 |
26152,05 |
357 |
73,26 |
|
|
|
Basicráneo |
92,84 |
4770,12 |
357 |
13,36 |
|
|
|
Masticatorio |
93,00 |
87652,82 |
357 |
245,53 |
|
|
|
Alveolar |
91,64 |
3988,57 |
357 |
11,17 |
|
|
|
ATM |
88,37 |
1944,40 |
357 |
5,45 |
|
|
|
Temporal |
96,02 |
53699,40 |
357 |
150,42 |
|
Las diferencias de forma son evidentes; la prueba del ANOVA anidado muestra diferencias significativas entre las transiciones estudiadas (Tabla 3) y entre las dietas dentro de cada transición, a excepción de la base del cráneo. En términos de varianza explicada, el cráneo completo (0,77%), el masticatorio (0,61%) y el temporal (0,44%) son las regiones que explican una mayor diversificación entre transiciones. Las mismas configuraciones craneales también son las que presentan mayor variación al analizar las diferencias entre las dietas. En conjunto, estos resultados sugieren que las variaciones de tamaño y forma que explican las diferencias entre dietas dentro de transiciones se concentran en las regiones más íntimamente relacionadas con la mecánica masticatoria.
Tabla 3
ANOVA anidado para la forma.
|
Efecto |
Región craneal |
η2 |
λ |
gl efecto |
gl error |
f |
|
Transición |
Cráneo entero |
0,77 |
0,23 |
86 |
626,00 |
7,89** |
|
|
Cara |
0,35 |
0,65 |
28 |
688,00 |
5,93** |
|
|
Cara superior |
0,22 |
0,78 |
10 |
706,00 |
9,24** |
|
|
Cara inferior |
0,28 |
0,72 |
20 |
694,00 |
6,13** |
|
|
Neurocráneo |
0,35 |
0,65 |
28 |
688,00 |
5,91** |
|
|
Bóveda |
0,28 |
0,72 |
18 |
698,00 |
6,93** |
|
|
Basicráneo |
0,07 |
0,93 |
8 |
706,00 |
3,48** |
|
|
Masticatorio |
0,61 |
0,39 |
60 |
654,00 |
6,49** |
|
|
Alveolar |
0,10 |
0,90 |
14 |
702,00 |
2,76** |
|
|
ATM |
0,10 |
0,90 |
6 |
710,00 |
6,61** |
|
|
Temporal |
0,44 |
0,56 |
34 |
682,00 |
6,70** |
|
Dieta (Transición) |
Cráneo entero |
0,80 |
0,20 |
172 |
1250,94 |
3,59** |
|
|
Cara |
0,39 |
0,61 |
56 |
1340,26 |
3,21** |
|
|
Cara superior |
0,20 |
0,80 |
20 |
1171,72 |
3,98** |
|
|
Cara inferior |
0,21 |
0,79 |
40 |
1317,64 |
2,11** |
|
|
Neurocráneo |
0,47 |
0,53 |
56 |
1340,26 |
4,21** |
|
|
Bóveda |
0,39 |
0,61 |
36 |
1309,60 |
5,20** |
|
|
Basicráneo |
0,06 |
0,94 |
16 |
1079,07 |
1,27 |
|
|
Masticatorio |
0,65 |
0,35 |
120 |
1302,51 |
3,30** |
|
|
Alveolar |
0,13 |
0,87 |
28 |
1266,97 |
1,73* |
|
|
ATM |
0,07 |
0,93 |
12 |
939,53 |
2,18* |
|
|
Temporal |
0,59 |
0,41 |
68 |
1340,50 |
5,09** |
Los resultados del análisis discriminante canónico (ADC) sobre las variables de forma, considerando tanto la transición como la dieta en tanto variables de agrupamiento (Tabla 4), muestran grandes diferencias entre las transiciones en casi todas las regiones del cráneo, con la excepción del basicráneo en la comparación Cuyo-México y Cuyo-Ohio. Dentro de las transiciones, las diferencias más notables se observan en la transición mexicana, en menor medida en Ohio, y finalmente, la transición de Cuyo exhibe las menores diferencias.
Tabla 4
Análisis discriminante canónico donde se consignan los valores de distancia de Mahalanobis y el porcentaje correcto de clasificación, para la comparación de a pares entre transiciones, y entre las economías dentro de cada transición.
|
Regiones craneales |
Distancia de Mahalanobis |
Porcentaje correcto de clasificación |
|
|
Cuyo-Méx |
Cuyo-Ohio |
Méx-Ohio |
Cuyo |
México |
Ohio |
Total |
|
Cráneo entero |
13,36** |
17,95** |
14,74** |
95 |
97 |
96 |
96 |
|
Cara |
3,18** |
4,40** |
3,02** |
33 |
92 |
69 |
80 |
|
Cara superior |
0,79** |
3,42** |
1,61** |
5 |
88 |
49 |
69 |
|
Cara inferior |
3,36** |
2,79** |
1,74** |
35 |
94 |
39 |
73 |
|
Neurocráneo |
4,51** |
4,29** |
1,91** |
48 |
90 |
54 |
76 |
|
Bóveda |
4,14** |
3,96** |
0,89** |
55 |
88 |
24 |
68 |
|
Basicráneo |
0,28 |
0,25 |
0,46** |
0 |
97 |
5 |
63 |
|
Masticatorio |
6,80** |
8,36** |
7,38** |
53 |
95 |
3 |
87 |
|
Alveolar |
0,90** |
0,90** |
0,86** |
13 |
93 |
24 |
67 |
|
ATM |
0,69** |
1,07** |
0,51** |
8 |
94 |
15 |
64 |
|
Temporal |
5,81** |
3,91** |
2,80** |
38 |
92 |
60 |
77 |
|
Cuyo |
|
CR-CU/A-CU |
|
CR-CU |
A-CU |
|
Total |
|
Cráneo entero |
|
53,73 |
|
100 |
100 |
|
100 |
|
Cara |
|
5,78* |
|
93 |
75 |
|
88 |
|
Cara superior |
|
2,31* |
|
89 |
67 |
|
83 |
|
Cara inferior |
|
3,03 |
|
93 |
83 |
|
90 |
|
Neurocráneo |
|
3,21 |
|
86 |
75 |
|
83 |
|
Bóveda |
|
2,14 |
|
89 |
33 |
|
73 |
|
Basicráneo |
|
0,22 |
|
96 |
0 |
|
69 |
|
Masticatorio |
|
28,38 |
|
100 |
100 |
|
100 |
|
Alveolar |
|
2,13 |
|
89 |
67 |
|
83 |
|
ATM |
|
0,45 |
|
93 |
17 |
|
70 |
|
Temporal |
|
9,87* |
|
100 |
83 |
|
95 |
|
México |
A-ME/COL-ME |
A-ME/MOD-ME |
COL-ME/MOD-ME |
A-ME |
COL-ME |
MOD-ME |
Total |
|
Cráneo entero |
7,10** |
14,54** |
6,58** |
83 |
92 |
84 |
89 |
|
Cara |
1,37** |
2,75** |
1,06** |
29 |
88 |
28 |
64 |
|
Cara superior |
0,75** |
0,78** |
0,18 |
19 |
96 |
0 |
62 |
|
Cara inferior |
0,73** |
1,14** |
0,24 |
15 |
96 |
7 |
62 |
|
Neurocráneo |
1,83** |
5,17** |
2,18** |
46 |
85 |
44 |
69 |
|
Bóveda |
1,66** |
4,92** |
1,52** |
46 |
84 |
33 |
67 |
|
Basicráneo |
0,29* |
0,37 |
0,04 |
0 |
99 |
0 |
60 |
|
Masticatorio |
4,29** |
7,48** |
3,98** |
69 |
87 |
60 |
78 |
|
Alveolar |
0,25 |
0,62 |
0,30 |
0 |
98 |
9 |
61 |
|
ATM |
0,57** |
0,44* |
0,16 |
17 |
98 |
2 |
63 |
|
Temporal |
3,66** |
5,87** |
2,95** |
65 |
87 |
53 |
76 |
|
Ohio |
|
CR-OH/A-OH |
|
CR-OH |
A-OH |
|
Total |
|
Cráneo entero |
|
24,27** |
|
100 |
100 |
|
100 |
|
Cara |
|
3,01* |
|
99 |
58 |
|
94 |
|
Cara superior |
|
2,31** |
|
98 |
25 |
|
88 |
|
Cara inferior |
|
1,78 |
|
99 |
25 |
|
89 |
|
Neurocráneo |
|
8,69** |
|
100 |
75 |
|
97 |
|
Bóveda |
|
4,36** |
|
99 |
58 |
|
94 |
|
Basicráneo |
|
1,11* |
|
100 |
25 |
|
90 |
|
Masticatorio |
|
9,20** |
|
100 |
83 |
|
98 |
|
Alveolar |
|
0,75 |
|
99 |
17 |
|
88 |
|
ATM |
|
0,19 |
|
100 |
0 |
|
87 |
|
Temporal |
|
8,76** |
|
99 |
75 |
|
96 |
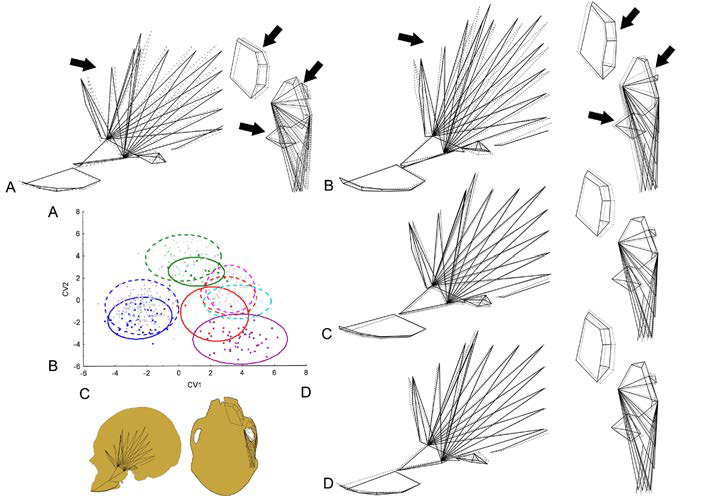
Para explorar con más profundidad la variación de forma debido a los efectos de la dieta, replicamos el ADC incluyendo las tres muestras no transitorias (Chubut, Doncellas y delta del río Paraná). Los criterios de clasificación combinan la información de origen de la población/transición y la dureza de la dieta. La primera variable canónica (VC1) muestra la separación entre la transición mexicana (valores positivos) y a los grupos sudamericanos (Cuyo más los tres grupos aislados) ocupando la región negativa del primer eje. La transición de Ohio se posiciona de manera intermedia dentro del VC1, pero se diferencia claramente en el segundo eje canónico (Figura 1). Las diferencias de forma a lo largo del primer eje implican cambios generales que afectan a las regiones frontal y occipital. Más específicamente, los grupos ubicados hacia los valores positivos de VC1 (México) presentan una proyección antero-posterior del cráneo. El segundo eje canónico discrimina a los grupos sudamericanos y mexicanos (valores positivos) de los grupos de Ohio (valores negativos), pero también contribuye a una interesante discriminación dentro de cada transición, en la que los grupos de dietas duras ocupan los lugares más bajos (de menor valor dentro del eje 2) en la nube de su propia transición. Para refinar más el análisis, desarrollamos un ADC utilizando solo la subconfiguración masticatoria (Figura 2). Este análisis tiende a confirmar el patrón anterior de un cambio de formas dentro de la cada transición entre DD y DB. Particularmente, el VC1 discrimina entre poblaciones/transiciones, mientras que el CV2 es informativo de cambios de forma “internos” que involucran a grupos que pertenecen a la misma transición. Los cambios de forma relacionados con los valores positivos, donde los grupos de dietas duras tienden a ubicarse dentro de su transición, involucran una inserción más posterior del músculo temporal orientado hacia atrás mientras que la porción anterior está orientada hacia adelante. El arco alveolar y el paladar muestran un cambio de forma pequeño o nulo en términos de proyección, pero más bien experimentan un cambio hacia una posición más medial. Además, los grupos de dieta dura se caracterizan por una ATM ubicada en una posición más basal y medial, mientras que el arco cigomático y la fosa temporal son más anchos. Los cambios opuestos se observan en los grupos de dieta blanda, ubicados en los valores negativos de VC2.
Figura 1
Análisis discriminante canónico del cráneo entero. Gráfico de dispersión de los dos primeros ejes canónicos (VC1 vs. VC2) y polígonos de deformación, en vista lateral izquierda y basal, de los valores extremos de cada VC. Las líneas punteadas representan la forma promedio, y las líneas continuas representan los valores extremos de cada VC. A) VC2 positivo; B) VC2 negativo; C) VC1 negativo; D) VC1 positivo. Cuadrados azules: DB México; cruces azules: DD México; cuadrados verdes: DB Ohio; cruces verdes: DD Ohio; cuadrados rojos: DB Cuyo; cruces rojas: DD Cuyo; cuadrados violetas: DB Doncellas; cruces celestes: DD Delta del Paraná; cruces rosas: DD Chubut.
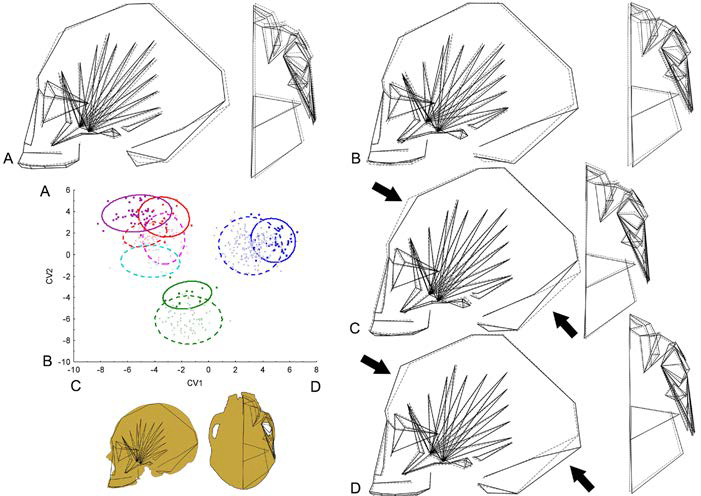
Figura 2
Análisis discriminante canónico de la región masticatoria. Gráfico de dispersión de los dos primeros ejes canónicos (VC1 vs. VC2) y polígonos de deformación, en vista lateral izquierda y basal, de los valores extremos de cada VC. Las líneas punteadas representan la forma promedio y las líneas continuas representan los valores extremos de cada VC. A) VC2 positivo; B) VC2 negativo; C) VC1 negativo; D) VC1 positivo. Cuadrados azules: DB México; cruces azules: DD México; cuadrados verdes: DB Ohio; cruces verdes: DD Ohio; cuadrados rojos: DB Cuyo; cruces rojas: DD Cuyo; cuadrados violetas: DB Doncellas; cruces celestes: DD Delta del Paraná; cruces rosas: DD Chubut.
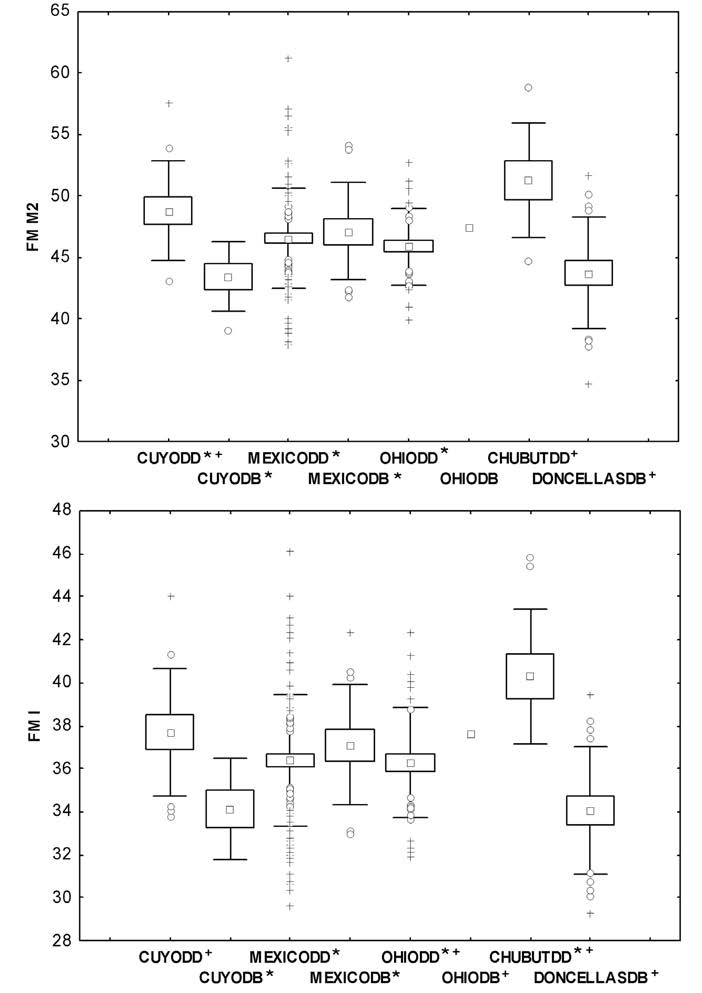
La fuerza de mordida (FM) se calculó por separado para individuos femeninos y masculinos. Los resultados del ANOVA de una vía para los individuos femeninos indican que las diferencias son estadísticamente significativas (FM M2 F= 4,78 p<0,00; FM I F=5,25 p<0,00). La Figura 3 muestra que la FM a nivel del segundo molar (FM M2) y de los incisivos centrales (FM I) presenta el mismo comportamiento. El valor más alto lo presenta Chubut (DD), mientras que el más bajo lo presenta Doncellas (DB). El test a posteriori (Test de Scheffé) para la FM M2 indica que Chubut (DD) difiere significativamente de Cuyo (DB), México (DD y DB) y Ohio (DD); por el otro lado, Doncellas (DB) también difiere de Cuyo (DD) y Chubut (DD). Para la FM I, el test indica que Chubut (DD) difiere de Cuyo (DB), México (DD y DB) y Ohio (DD); y por el otro lado, Doncellas (DB) difiere de Cuyo (DD), Ohio (DD y DB) y Chubut (DD). Dentro de cada transición, el comportamiento de las FM se corresponden a lo esperado solo en Cuyo, donde el grupo de DD presenta valores más altos de FM que el grupo de DB. En México y Ohio ocurre lo contrario, el mayor valor de FM lo presentan los grupos de DB.
Figura 3
Gráficos de caja de individuos femeninos de cada población según su tipo de dieta (DD y DB). FM M2: fuerza de mordida a nivel del segundo molar, FM I: fuerza de mordida a nivel de los incisivos centrales, cruces: valores extremos; círculos: valores outliers; cuadrados: media; caja: media ± error estándar; bigotes: media ± desvío estándar. Los símbolos */+ indican cuáles son los grupos que difieren estadísticamente entre sí.
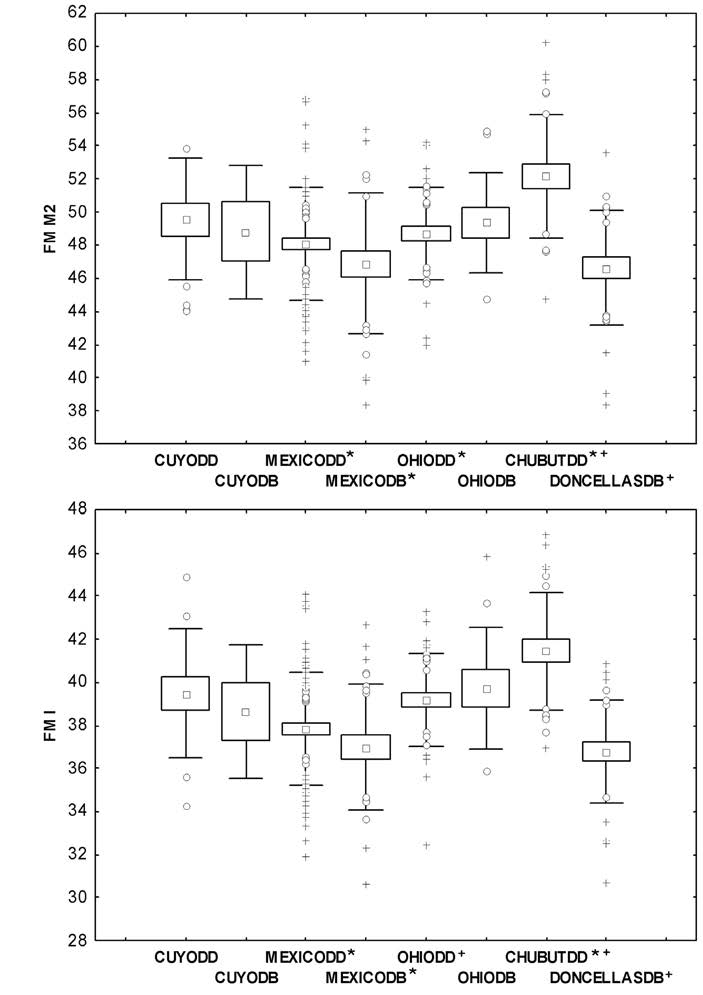
Para los individuos masculinos (Figura 4), ambas FM siguen el mismo patrón (FM M2 F=6,80 p<0,00; FM I F=9,70 p<0,00). De manera coincidente con los resultados obtenidos para los individuos femeninos, los masculinos de Chubut (DD) muestran los valores más altos, mientras que los Doncellas (DB), los más bajos. El test de Scheffé (test a posteriori) para la FM M2 indica que los grupos de Chubut (DD) difieren significativamente respecto de ambos grupos de México (DD y DB) y de Ohio (DD), y por otro lado, Doncellas (DB) difiere de Chubut (DD). El mismo análisis pero para la FM I indica que Chubut (DD) difiere de ambos grupos de México (DD y DB), y Doncellas (DB), de Ohio (DD) y Chubut (DD). Los resultados dentro de Cuyo y México concuerdan con lo esperado, ya que sus grupos de DD tienen valores más altos que los grupos de DB; esta tendencia se invierte en Ohio, donde la FM del grupo de DB es mayor.
Figura 4
Gráficos de caja de individuos masculinos de cada población según su tipo de dieta (DD y DB). FM M2: fuerza de mordida a nivel del segundo molar, FM I: fuerza de mordida a nivel de los incisivos centrales, cruces: valores extremos, círculos: valores outliers; cuadrados: media; caja: media ± error estándar; bigotes: media ± desvío estándar. Los símbolos */+ indican cuáles son los grupos que difieren estadísticamente entre sí.
Discusión
El estudio de la mecánica masticatoria y su influencia en la morfología craneofacial ha sido abordado desde diferentes enfoques (e.g., Carlson, 1979; Corruccini y Handler, 1980; Larsen, 1995, 1997; Sardi et al., 2006, entre otros). La mayoría de los trabajos que han utilizado poblaciones naturales para evaluar este fenómeno están realizados sobre grupos que contrastan en su modo de subsistencia y que además provienen de diferentes regiones geográficas (Corruccini y Handler, 1980; Larsen, 1995; González-José et al., 2005), por lo que las diferencias morfológicas no pueden ser atribuidas exclusivamente a la mecánica masticatoria. Es probable que una fracción desconocida de la variación se deba a diferencias en el acervo genético de las poblaciones analizadas. El escenario ideal para este tipo de análisis sería el experimental, en el cual se pueda tener controlada genética y ambientalmente a la población, saber exactamente cuál es la dureza de la dieta, calcular el trabajo muscular y luego medir el cambio morfológico, como es el caso del trabajo de Lieberman et al. (2004) con ejemplares del mamífero africano Procavia capensis. Sin embargo, resulta imposible de poner en práctica con poblaciones humanas del pasado. Una situación más cercana al ideal experimental es realizar estudios con grupos que muestren un continuo demográfico, eligiendo series poblacionales que cuenten con evidencia de haber experimentado una transición económica a lo largo de su historia evolutiva sin que haya mediado un cambio genético (por deriva, migración, etc.) de alta magnitud. Este tipo de series pueden ser vistas como “experimentos naturales”, de los cuales solo se han publicado pocos trabajos (e.g., Carlson, 1976; Carlson y Van Gerven, 1977; Sardi et al., 2006; Paschetta et al., 2010, 2016).
Las evaluaciones del tamaño y la forma realizadas aquí indican que existen mayor cantidad de diferencias entre las transiciones, que entre las economías dentro de las transiciones. Estas diferencias poblacionales son la consecuencia del proceso de poblamiento que tuvo lugar en el continente americano (Neves y Pucciarelli, 1991; Merriwether, Rothhammer y Ferrel, 1995; González-José et al., 2008). Las diferencias de tamaño se manifiestan en casi todas las regiones del cráneo; son excepciones las temporal y alveolar (Tabla 2), mientras que para la forma, las diferencias aparecen en todo el cráneo (Tabla 3). Cuando los cambios morfológicos son la consecuencia de un efecto ambiental particular (e.g., masticación), se espera que estén puntualmente localizados sobre las estructuras implicadas en el proceso evaluado. En este sentido, varios autores (e.g. Carlson, 1976; Carlson y Van Gerven, 1977; Ingervall y Bitsanis, 1987; González-José et al., 2005; Sardi et al., 2006; Paschetta et al., 2010) encontraron que, al comparar grupos de humanos con diferentes estrategias económicas, las estructuras masticatorias muestran mayor cantidad de diferencias relativas en la forma que el resto de las estructuras craneales, lo cual refleja así el potencial de plasticidad morfológica como respuesta a la dureza de la dieta. Asimismo, en un trabajo anterior, realizado con las mismas muestras transicionales analizadas aquí (Paschetta et al., 2016), en el que se evaluó el grado de integración y variabilidad morfológica, los grupos caracterizados por DB ocuparon nuevas regiones en el morfoespacio a nivel del borde alveolar y la cara inferior. La transición hacia dietas blandas da lugar a la expresión de nuevos fenotipos; en otras palabras, se expresan novedades de formas que no se habían observado antes. Los resultados del trabajo de Eyquem y colaboradores (2019) también coinciden en que la variación encontrada en la región maxilar de las poblaciones modernas/urbanas -que representan las dietas más procesadas- es mayor debido a la reducción de las limitaciones funcionales impuestas por la dieta dura; es decir, el cambio en los cráneos no es generalizado sino que está puntualmente localizado en las estructuras relacionadas con el proceso masticatorio.
El efecto de las DD y DB sobre el tamaño se hace evidente en prácticamente todas las regiones craneanas (Tabla 2). Entre las transiciones, el neurocráneo es la subregión que muestra el mayor porcentaje de variabilidad. Este resultado, a pesar de no haber sido reportado previamente, es coherente con el proceso biológico involucrado y la metodología utilizada en este trabajo, ya que parte de los landmarks ubicados sobre la región neurocraneana forman parte de la inserción del músculo temporal. Emerson y Bramble (1993) sostienen que, en mamíferos, la evolución del neurocráneo se encuentra estrechamente relacionada desde el punto de vista funcional con el esplacnocráneo. Al evaluar el efecto de las dietas dentro de las transiciones, el mayor porcentaje de varianza se explica por las diferencias en la región facial inferior (Tabla 2). Este resultado es coincidente con los trabajos previos que la señalan como una de las zonas que mayor carga soporta durante la masticación (e.g., Hylander et al., 1991; Hylander y Johnson, 1992; Ross y Hylander, 1996; Ross, 2001; Lieberman, 2011). La única región que no se diferencia cuando se evalúan ambos efectos (transición y dieta) es la temporal. Mientras que en el resto del cráneo, el cambio hacia una DB se caracteriza por una disminución de tamaño, en dicha región no se cumple esta generalidad (Carlson, 1976; Carlson y Van Gerven, 1977; González-José et al., 2005; Sardi et al., 2006). Es importante tener en cuenta que el aumento o la disminución del tamaño de una estructura no necesariamente implican un cambio a nivel biomecánico (como mayor o menor fuerza de mordida). Pueden existir otras respuestas alternativas al mismo problema; por ejemplo, para procesar alimentos más duros se puede aumentar el número de ciclos masticatorios (Iguchi et al., 2015). Las regiones temporal y masticatoria de las series analizadas representan las configuraciones con mayores porcentaje de variación, es decir, donde el efecto de las transiciones y las dietas sobre la forma del cráneo se hace más evidente, estos resultados coinciden con estudios previos (Carlson, 1976; Carlson y Van Gerven, 1977; González-José et al. 2005; Sardi et al. 2006; Paschetta et al. 2010).
Nuestros resultados también permitieron explorar los cambios de forma que definen los grupos de dieta dura versus blanda (Tabla 4, Figuras 1 y 2). Este análisis se complementó con la incorporación de tres grupos no transicionales: Chubut, delta del río Paraná y Doncellas, con el fin de verificar si el patrón observado entre las transiciones se cumple en grupos con diferentes estilos de vida. Como era esperado, el primer eje del análisis discriminante muestra la diferencia geográfica intergrupal, mientras que los cambios morfológicos a lo largo del segundo eje canónico representan las diferencias dentro de las transiciones. Ambos tipos de dietas mantienen la misma posición relativa dentro de cada transición, lo que sugiere que existe un patrón que define el cambio de DD a DB, más allá de las peculiaridades de los acervos genéticos y de la historia poblacional. Estos cambios de forma involucran al arco cigomático, que es más ancho y largo en los grupos de DD (Figura 2). La superficie inferior del arco es el área de inserción del músculo masetero, uno de los principales músculos involucrados en el cierre de la mandíbula (Testut y Latarjet, 1954; Latarjet y Ruiz Liard, 2007). La intensa actividad muscular por consumo de DD promovería el crecimiento de las regiones de inserción involucradas (Kennedy, 1989; Capasso, Kennedy y Wilczak, 1999; Weiss, 2010). Otro cambio detectado en los grupos de DD es el ensanchamiento de la fosa temporal (Figura 2), lo que implica indirectamente un mayor tamaño del músculo temporal que atraviesa la misma. Si bien el paladar, la arcada alveolar y la ATM no muestran grandes cambios de forma (Figura 2), sí dejan en evidencia un desplazamiento de los mismos en su posición relativa con respecto a todo el cráneo. Es importante resaltar que la ATM actúa como una palanca de tercera clase (Latarjet y Ruiz Liard, 2007), en la que el punto de carga se ubica en un extremo (contactando con la comida), el punto de apoyo en el extremo opuesto (interacción cóndilo y fosa) y el esfuerzo que ejecuta el músculo se aplica en un punto intermedio entre la carga y el punto de apoyo. Una palanca estará en equilibrio cuando el brazo de fuerza y el brazo de carga sean equivalentes; es decir, cuando el producto entre la fuerza actuante (F) y su distancia al punto de apoyo (dF) sea igual al producto de la carga o resistencia (R) por su distancia al punto de apoyo (dR) (Latarjet y Ruiz Liard, 2007). Cuando se modifica cualquiera de estos cuatro términos, el resto debe ajustarse para restablecer el equilibrio. En este contexto, los cambios en la posición relativa del paladar, el arco alveolar y ATM hacia una posición más lateral en los grupos de DB aumentan la longitud del brazo de esfuerzo, lo que deriva en una disminución de la fuerza de mordida. Es importante señalar que la FM constituye un parámetro muy informativo que no puede ser analizado de manera aislada, ya que no se cuenta con datos sobre el número compensatorio de ciclos de masticación que pueden haber experimentado los grupos que consumieron DD. Coincidimos con el trabajo de Menéndez, Bernal, Novellino y Pérez (2014), que estiman la FM y su contribución al patrón de variación morfológica, destacando la compleja relación entre fenotipo y diversificación de la dieta.
Otro cambio importante de forma ocurre en la región craneal lateral, donde se inserta el musculo temporal. Tiene forma de abanico, cuya base se dirige hacia arriba y atrás, y su vértice se localiza en la apófisis coronoides de la mandíbula (Testut y Latarjet, 1954; Latarjet y Ruiz Liard, 2007). Los grupos de DB presentan una inserción anterior del músculo temporal desplazada hacia atrás, mientras que la región posterior está desplazada hacia delante. Este cambio produce una constricción anteroposterior y un área muscular más pequeña. En los grupos de DD, se registra en el sentido opuesto: la región anterior del músculo se mueve hacia delante y la región posterior hacia atrás, aumentando el área muscular (Figura 2). Estos cambios de forma son consistentes con trabajos previos (Carlson, 1976; Carlson y Van Gerven, 1977; González-José et al., 2005; Sardi et al., 2006; Paschetta et al., 2010), lo que sugiere que el consumo de alimentos duros promueve un aumento en el área del músculo temporal. En general, todos los cambios morfológicos mencionados parecen responder a demandas funcionales relacionadas con modificaciones en las características de la dieta. Los cambios de posición (paladar, arco alveolar y ATM) y de extensión del musculo temporal son sutiles. Katz, Grote y Weaver (2017), en un estudio que abarca muestras de todo el mundo, sugirieron que las variaciones morfológicas no necesitan ser masivas para tener impacto funcional profundo. Los autores sostienen que las pequeñas magnitudes del efecto de la dieta son consistentes con los estudios que cuantifican los principales componentes de la varianza de la genética humana global y la diversidad craneal, donde la mayor parte de la variación se encuentra dentro de los grupos.
En conclusión, la evaluación de los cambios de tamaño y forma y el cálculo de un parámetro biomecánico (fuerza de mordida), evaluados dentro de un continuo poblacional (transiciones), brinda información valiosa proveniente de diferentes fuentes de variación. Ayuda a comprender con mayor profundidad los efectos del proceso masticatorio sobre la morfología craneofacial en su totalidad y en las subestructuras craneales, sobre todo en aquellas que sufren alto estrés masticatorio.
![]() 0000-0002-8128-9381 Rolando González-José[1][**]
0000-0002-8128-9381 Rolando González-José[1][**]